Последние записи
КОЛХИЦИН И ЛИЛЕЙНИКИСреда, 08 Декабря 2010, 17:53:23Эта статья, будет началом раздела " Интересные истории из мира Hemerocallis " ВВЕДЕНИЕ Полиплоидия – это наследственные изменения, связанные с увеличением числа целых хромосомных наборов . Для индуцирования полиплоидных форм используют различные факторы воздействия: механические, физические, химические и др. Искусственно полученные мутантные формы являются ценным материалом для селекции, поскольку в контролируемых условиях можно получить мутации, отсутствующие в природе или встречающиеся очень редко. Искусственная полиплоидия играет важную роль в улучшении многих видов растений и гибридов. Результат индуцированной полиплоидии гемерокаллис Hemerocallis, помимо увеличения генетической изменчивости, проявляется новыми формами и качеством фенотипа тетраплоидного лилейника. Цветок тетраплоид – большего размера, тяжелой субстанции, более округлой формы и богатой цветовой гаммы (Stamile 1990, Kehr 1996, Callaway 2000, Sakhonokho 2003). Цветонос имеет прочный, толстый стебель, позволяющий удерживать большие, плотные, массивные цветы. Из-за этих качеств, селекционеры выбрали и использовали полиплоидные формы в своих гибридизационных программах потому, что большинство потребителей цветоводов предпочитают улучшенные цветоводческие признаки тетраплоидных аналогов лилейника. Генетическое разнообразие в пределах современных тетраплоидных лилейников быстро уменьшается, поскольку производители –гибридизаторы сфокусировались на ограниченном числе тетраплоидных генотипов, с уникальными цветочными признаками (Tomkins, Wood, Barnes, Westman, Wing 2001). Эта ситуация может иметь серьезные последствия, влекущие негативные изменения окружающей среды. Подтверждением этого служит появление в 2000 году новой болезни лилейников – ржавчины. Назрела необходимость расширения тетраплоидной гермаплазмы лилейников за счет преобразования более генетически разнообразных диплоидных аналогов, для использования в новых тетраплоидных программах разведения. ПЛОИДНОСТЬ HEMEROCALLIS Попробуем для лучшего понимания процесса полиплоидизации немного разобраться в более упрощенном виде с некоторыми определениями в генетике. Каждый отдельный вид животных или растений имеет характерное, постоянное число хромосом. Плоидность означает , степень кратности , этого основного числа хромосом. Для того, что бы понять определение плоидности Hemerocallis , вспомним, что цветок лилейника имеет мужские (тычинки с пыльниками) и женские (рыльце пестика, трубка пестика ведущая к яичнику) репродуктивные части, которые производят мужские и женские половые клетки - гаметы . Гаметы имеют гаплоидный набор хромосом (n ) т.е одинарный набор хромосом, присущий половым клеткам и у лилейников гамета содержит 11 хромосом. Гаплоидное число хромосом в клетках организмов одного вида называется основным или базовым, а совокупность генов, заключенных в таком гаплоидном наборе - геномом. При половом созревании в клетках происходит альтернативный процесс клеточного деления, в результате которого, образуются гаметы. Этот процесс называется - мейоз. Он включает два отдельных этапа. Многоступенчатая природа процесса гарантирует, что каждая яйцеклетка или сперматозоид содержит только один полный набор хромосом (гаплоидный ). При оплодотворении, т.е. слиянии мужской (спермии) гаметы и женской (яйцеклетка) гаметы, получается диплоидная зигота, развивающаяся в особь с наследственными признаками обоих родительских организмов. Для зигот и всех соматических клеток характерен диплоидный, двойной набор хромосом, для лилейников (2п = 22). Один набор 11 хромосом, происходит от яйцеклетки (материнского организма), второй комплект из 11 хромосом, от сперматозоида пыльцы (отцовского организма). При слиянии двух гаплоидных гамет в зиготу, происходит восстановление присущего данному виду организмов, диплоидного набора хромосом. Делаем вывод – диплоидные лилейники имеют 22 хромосомы . По своему природному происхождению большинство видовых лилейников - диплоидные (Takenaka 1929, Stout 1932, Brannan 1992, Tomkins 2003, 2004).  Полиплоидия может возникнуть при нерасхождении хромосом в мейозе. В этом случае половая клетка получает полный (нередуцированный) набор хромосом соматической клетки (2n). При слиянии такой гаметы с нормальной (n), образуется триплоидная зигота (3n), из которой развивается триплоид. Триплоидные лилейники имеют тройной набор хромосом ( 3n=33 ) и получаются при слиянии нередуцированной гаметы с нормальной гаплоидной. Триплоиды, как правило, бесплодны (стерильны). Природа стерильности у них очевидна. Во время первого этапа мейоза схожие хромосомы (называемые «гомологичными» хромосомами) в клетке, перед делением объединяются в пары. В триплоидной клетке, этот основной этап мейотического процесса работает не точно, потому что гомологичные хромосомы не могут объединиться в пары и разделиться поровну. Такой сбой мейотического деления и объясняет стерильность триплоидов. Несколько таксонов видового комплекса Hemerocallis fulva ( H.fulva “ Europa “, H.fulva” Kwanso “, H. fulva var. paucijiora Hotta & Matsuoka , H. fulva var. Maculate Baroni ) в результате спонтанных мутаций (изменения физиологического состояния клетки), являются по происхождению – триплоидами (2n=3x=33) (Stout 1932, Chandler 1940). Эти представители триплоидных не были получены в результате пересечений тетраплоидов с диплоидами. На то время не существовало в природе тетраплоидных представителей Hemerocallis. Так как большинство триплоидных лилейников являются результатом скрещивания между тетраплоидными (44 хромосомы) и диплодными (22 хромосомы) родителями, когда при рекомбинации 2n- и n- гамет образуется триплоидный организм. С наибольшей вероятностью триплоидные лилейники произошли из нередуцированной клетки яйца. В 1970 году д-р Arisumi сообщил о серии экспериментов, которые он провел с 1961 по 1969 год по перекрестному опылению диплоидных и тетраплоидных саженцев лилейников, и оценил частоту нередуцированных яйцеклеток, как 1/15000. При этом, он ни разу не находил нередуцированную клетку зерна пыльцы. В некотором виде триплоиды могут легко создаваться в результате скрещивания диплоидов с тетраплоидами. Тем не менее у лилейников Arisumi (1973) получал только 29 триплоидных саженцев из 1607 пересечений диплоидов с тетраплоидами. Частота успеха удваивалась, когда родитель тетраплоид был женским. Имеется много сообщений от любителей гибридизаторов о получении триплоидных саженцев от дип/тет пересечений, тем не менее, чаще всего эти “ триплоиды “, оказывались диплоидами. Родитель тетраплоид использованный в этих пересечениях, обычно был производным от колхицин-индуцированной тетраплоидной химеры (R.A.Griesbach). Даже если триплоидные лилейники слабо плодородные, они могут использоваться в разведении. Д-р Stout (1926 ) получал 1% жизнеспособных семян, при использовании Hemerocallis fulva “ Europa “ , как женский родитель и 15 % жизнеспособных семян, при использовании “Europa “, как мужской родитель. Триплоидные лилейники, также очень хороший исходный материал для разведения гексаплоидных , методом удвоения хромосом (Morejohn 1987). По словам Levin (1983) и Horn(2002) разработка гексаплоидных лилейников может увеличить размеры цветка, активизировать цветовую гамму, изменять форму цветка и способствовать восстановлению плодородия от триплоидов. Создание гексаплоидной зародышевой плазмы лилейников, значительно бы увеличила возможности гибридизаторов для дальнейшего совершенствования традиционной гермаплазмы. Только диплоидные и триплоидные виды Hemerocallis встречаются в природе. Тетраплоидные лилейники были получены искусственно, путем удвоения числа хромосом, в результате воздействия химического вещества, в частности – колхицина. Механизм действия колхицина сводится к нарушению расхождения хромосом в митозе и образованию клеток с кратно увеличенным числом хромосом по сравнению с исходной клеткой. Тетраплоидные лилейники имеют четыре набора хромосом (4n=44 хромосомы).  Знание уровня плоидности – полного набора хромосом лилейника, имеет решающее значение для программы гибридизации. Желаемые скрещивания, как правило, трудно получить от родителей различного уровня плоидности. ИСТОРИЯ ПОЛИПЛОИДИЗАЦИИ Полиплоидия - является важным фактором в разработке усовершенствованных коммерческих сортов и гибридов. Одним из перспективных направлений в селекции, является химическая полиплоидизация. В 1937 году, впервые была обнаружена способность колхицина производить полиплоидизацию (Blakeslee and Avery 1937), способность искусственного манипулирования хромосомными числами активно использовалась в течение 1940 года для создания первых тетраплоидов. Мощный алкалоид колхицин , выделенный из луковиц безвременника ( Colchicum Autumnale ) , парализует веретено деления, вследствие чего становится невозможным расхождение дочерних хромосом к полюсам и они остаются в одной клетке. В результате, образуется клетка с удвоенным числом хромосом. История колхицина Первые знания о колхицине настолько стары, что уходят своими корнями в древнюю историю и мифологию Греции, Индии и Египта. Колхицин (Colchicinii) назван в честь земли Колхиды, которая находится в восточной части Черного моря. Где все ее побережье ранней осенью покрывается яркими розовыми и голубыми цветками безвременника или , как его еще называют - крокуса осеннего, безвременника лугового. Куда приходил со своими аргонавтами Ясон за Золотым Руном. Там, в Колхиде он встретил колдунью Медею, верховную жрицу богини Лейкотеи и очень опытного врача, вернувшей «доблестному Ясону силу юности, отогнав старость хитроумным способом с помощью трав, кипевших в золотом сосуде». Именно ее волшебные силы связывают с ядовитыми компонентами безвременника. Древние короли Колхиды использовали знания о растительных ядах, для устранения конкурентов и быстрого решения всех дворцовых интриг. В эти места путешествовал древнегреческий врач - натуралист Диоскорид ( Dioscorides ). Он первый дал точное описание, указывающее фазы роста, морфологию и размножение безвременника осеннего и дал ему название Colchicon . Зарисовки Диоскорида, включающие растение безвременника с плодами и семенами, и растение с листьями и цветами, копировались на протяжении пятнадцати столетий. На то время профессии врача и ботаника были тесно связаны и конечно же, Диоскорид имел медицинский интерес к этому ядовитому лекарственному растению .  В Египте самым ранним датированным фактом до нашей эры, является упоминание безвременника в Папирусе Ebers – старейшем медицинском тексте, в 1550 году до нашей эры. Папирус Ebers суммировал все медицинские знания Египетской цивилизации, которые дошли до современной фармакопеи. На сегодняшний день, фактически только 18 растений из семисот первоначально заявленных в документе, достигли своей исторической славы. Трудно предположить сколько столетий прошло с тех пор, когда древние индусы начали сбор безвременника осеннего и других лекарственных растений, для применения в медицинской практике. Некоторые древние медицинский трактаты Индии до сих пор не расшифрованы. В Ведических текстах 800 г до н. э. упоминается Colchicum luteum, производитель чистого колхицина (0,2 %), собранный в Кашмире (Kashmir), в северо-западных предгорьях Гималаев. Древние арабские врачи заимствовали знания о лечебных свойствах колхицина от своих коллег из Индии и продвигали их дальше, в Европу. На протяжении многих веков колхицин изучался медиками, алхимиками, натуралистами. Такие исторические имена, как Теофраст, Авиценна, Гален внесли свой вклад в изучение и практическое применение колхикума, как медицинского лекарственного растения. Современный период исследования колхицина начинается с 1989 года , когда сицилийский патологоанатом Pernice (1884 – 1906) впервые описывает влияние колхицина на митоз животной клетки, при введении большой дозы яда. Есть упоминание, что ранние эксперименты с колхицином проводил Чарльз Дарвин в 1875 году, но его работа имела только исторический интерес и никаких документальных подтверждений на данное время не существует. Колхицин в своей настоящей роли, как митотический яд и как средство для биологического исследования было обнаружено в 1931 году в Брюсселе (Бельгия), в лаборатории профессора Дастина (A.R. Dustin), который долгое время исследовал митоз. К 1937 году многие лаборатории всех континентов подключаются к исследованию эффекта колхицина в митозе. Генетики Швеции и Японии. Во Франции Gavaudan вел активное сотрудничество с бельгийскими генетиками. В России лаборатория Института Генетики АН СССР под руководством академика Н. Вавилова. Д. Костов, И. А. Аксамитная. - Докл. АН СССР, 1935, "Исследование полиплоидных растений". В феврале 1937 года, в Cold Spring Harbor в Нью-Йорке, на Атлантическом собрании E.L.Lahr представил работу группы генетиков Allen, Gardner, Smitt, об исследовании колхицина и влиянии его на полиплоидизацию, ученым исследовательской лаборатории Университета Карнеги, Отдел Генетики, возглавляемый доктором A.F. Blakeslee. Эта работа создала широчайший интерес ученых всего мира. В сентябре этого же года Blakeslee объявил об открытии колхицина, как мощного химического реагента, порождающего полиплоидию в растениях. Колхицин заменял практически все известные методы, использованные для увеличения количества хромосом в растении. Процедура была новой и могла легко проводиться на всех представителях растений. В течение короткого времени генетики убедились, что найдено уникальное, полезное средство, поскольку метод колхицинирования , был более эффективным и более пригодным для получения полиплоидов, имеющих дополнительный комплект хромосом, чем любые другие методы, которые использовались прежде. Метод колхицинирования стал потрясением для агрономов. По всему миру ученые и аматоры начали создавать полиплоиды. То, что техника использования колхицина оказалась простой, посодействовало интересу ее быстрого распространения и использования. На протяжении пяти лет, с 1938 по 1942 год , все растения –представители сельского хозяйства Швеции, были преобразованы в полиплоиды. Началась новая эра в полиплоидизации. История тетраплоидного лилейника В 1947 году был получен первый цветущий экземпляр тетраплоидного лилейника “ Brilliant Glow” из преобразованного сорта “Cressida” , автором был студент Университета Minnesota - Robert Schreiner . В 1948 году , Buck Quinn из Университета в Калифорнии , сообщал о цветении тетраплоидов “ Soudan “ и “ Kanapaha “ . Годом позже , Hamilton Traub , Отдел Сельского хозяйства США в Beltsville , Maryland , преобразовал сорт “ Mayor Starzynski “ и назвал его “ Tetra Starzynski “. Впервые д-р Трауб (Traub) дал полное описание своих экспериментов. Полученный тетраплоид был описан, как “полный Tet “ (Traub 1959, 1960). Понятие «полный» указывает на то, что растение полностью преобразовано в тетраплоид, т.к. в результате конверсии высока возможность получения «химеры» - растения лилейника имеющего диплоидные и тетраплоидные ткани. Об этом мы поговорим чуть позже. В гибридизации лилейников, желательно использовать полный тетраплоид. Первые тетраплоиды, не были такими же плодородными, как диплоиды (Peck and Peck 1969). Со временем, более плодородные тетраплоиды были отобраны к разведению. Первая основная программа разведения тетраплоидов была начата в 1955 году в Университете De Paul в Чикаго (Illinois) доктором Роберт Грисбах (Robert A. Griesbach) и отставным химиком Орвил Фей (Orville Fay).   Они разработали и представили новый метод обработки семян лилейника колхицином. Семенная обработка была легче и более эффективной, чем обработка целого растения, которую проводили раньше R. Schreiner и Н.Traub ( Traub 1959, 1960). С использованием семенной обработки можно было в очень короткие сроки получить большее количество преобразованных растений. Кроме того, семенная обработка заканчивалась более высокой частотой получения тетраплоидов (Griesbach и др. 1963). Кроме издания методик обработки, Dr. Griesbach проводил многочисленные практические занятия для коммерческих и любительских производителей лилейников.  В 1961 году О. Фей (Fay) и д-р Р. Грисбах (Griesbach) представили цветоводческому миру четыре тетраплоидных сорта Crestwood Ann, Crestwood Bicolor, Crestwood Evening, Crestwood Lucy. В 1963 году они добавили Crestwood Gold и в 1967 году - Mary Todd и Golden Surrey. В дальнейшем сорт Mary Todd будет первым тетраплоидом, завоевавшим в 1978 году наивысшую награду, присуждаемую Американским Обществом Лилейника (AHS) – Серебряную Медаль Стаута (Stout Silver Medal). В отличие от прежде выпущенных тетраплоидных сортов, серия Crestwood была высоко оценена и широко распространена для дальнейшего разведения. Началась новая волна в гибридизации лилейников. В 1964 году в Отделе Сельского хозяйства США (Maryland), доктором Toru Arisumi был представлен метод преобразования открытой вегетативной меристемы. Метод оказался очень успешным и высоко действенным для преобразования диплоидных сортов в тетраплоидные аналоги. Этот метод широко использовался цветоводами-любителями в течение 1960-х и 1970-х годов, для расширения тетраплоидного генофонда лилейника (Traub 1972). Доктором Тори Арисуми (Toru Arisumi) в 1964 году было преобразовано семнадцать диплоидных сортов. В это время, в штате Иллинойс ( Illinois) активно ведет работу по конверсии Чарльз Рикемп (Charles Reckamp).  Его работа была примечательна тем, что он получил много тетраплоидных сортов с оттенками желтых и дынных цветов. Два университетских профессора д-р Virginia Peck и д-р Richard Peck, начали свою интенсивную работу по конверсии лилейников в 1960 году, результаты которой все еще успешно применяются в гибридизации. Вскоре сотни преданных аматоров и профессионалов подключаются к работе с тетраплоидными сортами. К 1967 году в США насчитывалось 66 тетраплоидных лилейников выращенных из семян и 17 сортов, которые были получены в результате конверсии с применением колхицина. Все они были зарегистрированы Американским Обществом Hemerocallis (AHS). С 1996 года все победители премии Стаута (Stout Silver Medal) - наивысшей награды AHS, являются тетраплоидными представителями лилейников. В настоящее время P. Stamile - садовод и гибридизатор из Флориды, стоит в числе первых самых плодовитых тетраплоидных селекционеров.  На его счету, начиная с 1996 года, три завоеванных Серебряных Медали Стаута. Тысячи коллекционеров покупают лучших генетических представителей лилейников и делают новые шаги в разведении. Создается впечатление, что все производители Hemerocallis в мире работают вместе над одним глобальным проектом по выведению лилейников с большими цветами, уникальными оборками, богатейшей гаммой расцветок, новыми образцами форм и другими удивительными и желаемыми характеристиками. В целом, это стало, по сути, крупнейшим проектом разведения в мире, больше чем ирисы и хосты, больше чем розы и кукуруза, перешагнув даже, животноводство (R. Merсer 2010). На данном этапе лилейник является одной из наиболее экономически важных разновидностей декоративных растений в торговле США, из-за его эффектных цветов с большой вариацией размеров и всевозможных уникальных расцветок, а так же, адаптации к широкому ряду почвенных и климатических условий (R.W.Munson 1989).  ПОЛИПЛОИДНЫЕ МУТАЦИИ И МУТАГЕНЫ Метод искусственного получения жизнеспособных полезных мутаций становится все более важным в селекции растений. Уже разработано много приемов индуцирования мутаций. В основе их лежит воздействие на организмы различными физическими и химическими факторами, называемыми мутагенами. Из них используют, главным образом изменения различного типа и некоторые химические вещества. Действуя этими факторами на растения можно резко повысить их мутационную изменчивость и отобрать среди многих вредных и бесполезных мутантов единичные ценные образцы и использовать их при выведении новых сортов. Полиплоидия - кратное увеличение числа хромосом в клетках, может возникать под действием высокой или низкой температуры, ионизирующих излучений, химических веществ, а также в результате изменения физиологического состояния клетки. Механизм действия этих факторов сводится к нарушению расхождения хромосом в митозе или мейозе и образованию клеток с кратно увеличенным числом хромосом по сравнению с исходной клеткой. Эффективность полиплоидизации в значительной степени определяется генетическими особенностями обрабатываемого материала, стадией его развития в момент обработки, способами обработки, концентрацией и температурой применяемого раствора, продолжительностью воздействия. Оптимальные условия обработки устанавливают для каждого объекта опытным путем. Мутационные изменения могут затрагивать любой признак. Доза мутагенов подбирается таким образом, что бы погибало не более 30-50% обработанных объектов. Установлено, что по мере увеличения концентрации мутагена до определенного уровня, частота жизнеспособных мутаций возрастает, а затем происходит ее снижение в результате гибели клеток, в которых возникли изменения при повышении концентрации мутагена сверх оптимальной величины. Полученные мутантные формы дают непосредственно начало новому сорту или используются в дальнейшей селекционной работе.  Hemerocallis неоднократно, с 1992 года принимал участие в экспериментах на космических станциях “Мир“ и “Шаттл". Где в условиях космоса изучались хромосомные и ядерные аномалии происходящие в условиях стресса, эффекты мутации в условиях ионизирующей радиации и микрогравитации, разрабатывалась методология анализа кариотипа с применением колхицина, разведение лилейников методом культуры ткани в условиях космоса.  К настоящему времени методы, используемые гибридизаторами лилейников для преобразования диплоидной гермаплазмы с помощью митотических ингибиторов - колхицин , оризалин, трифлуралин, амипрофос-метил, кофеин, парадихлорбензол, бета-оксихинолин и др. , включают: технику воздействия на прорастающие семена, полиплоидизация методом культуры ткани, преобразование открытой меристемной области, инъекционный метод. Из химических агентов, вызывающих нарушение правильного расхождения хромосом, наиболее эффективен алкалоид колхицин. Он относится к так называемым- митозным ядам . Митозные яды разрушают микротрубочки веретена деления, что делает невозможным нормальное расхождение хромосом в митозе или мейозе. Практически, все работы по преобразованию диплоидных лилейников в тетраплоидные, имеющие научное обоснование, проходили с использованием колхицина. Все остальные мутагены для увеличения плоидности лилейников использовались гибридизаторами любителями в частных исследовательских экспериментах В том числе есть эксперименты, которые ведутся с 2003 года по использованию мутагенного воздействия на семена лилейника и хосты инфракрасным излучением (S.Zolock 2003). В Университете штата Канзас проводились опыты воздействия радиоактивными изотопами в виде инъекции в цветонос лилейника. Изучался процесс работы впрыска и его результативность. Гибридизаторы - аматоры активно ведут эксперименты по применению кофеина, для обработки семян в целях полиплоидизации лилейников. Применение гербицидов, таких как - оризалин (Oryzalin) и трифлуралин (Treflan) в малых дозах концентрации можно использовать для удвоения хромосом лилейников, как для обработки самого растения, так и его семян. Оризалин влияет на деление клеток так же, как и колхицин, но более эффективно и с меньшей токсичностью по отношению к пользователю. Оризалин доступен в продаже, как гербицид сурфлан Surflan – AS ( 40% oryzalin). Оризалин труднорастворим в воде. Предварительно растворяют 0,5 мл, 40% oryzalin в 100 мл теплого изопропилового спирта или водки, добавляют 2 столовые ложки 99% ДМСО (диметилсульфоксид). Постепенно добавить теплой воды 3 литра 900 мл. Получаем раствор приблизительно 0, 005 % оризалин, готовый к обработке растений. Раствор для преобразования инъекционным методом с использованием Surflan( оризалин ), который предлагает Джеймс Госсард : 1. Чистый оризалин – 99,9% , также известный , как 3,5-динитро-N4N4-дипропил-сульфанимид. Готовим исходный раствор : растворить 0, 3463 грамма оризалина в 1-2 мл ДМСО ( диметилсульфоксид ) и разбавить дистиллированной водой до 100мл. Готовим рабочий раствор : развести 1 мл исходного раствора в 100 мл дистиллированной или деионизированной воды ( по желанию добавить 1-2 мл ДМСО ) 2. Surflan AS (оризалин 40,4 % ) Готовим исходный раствор: Растворить 0,857 грамма ( около 1 мл ) сурфлана в дистиллированной или деионизированной воде и разбавить до 100 мл . Готовим рабочий раствор : Развести 1 мл исходного раствора в дистиллированной воде . Добавить 1-2 мл ДМСО . Существует очень широкий диапазон концентраций сурфлана, которые используются цветоводами для полиплоидизации. Тони Авент (Северная Каролина) использует 1% - 0,5 % раствор для хост, Кевин Вон ( USDA) - 0,003 % для лилейников, Артур Эванс ( Арканзас) использует 0, 005 % раствор оризалина для восточных и азиатских лилий. Теперь поговорим о мутагенном воздействии колхицина на лилейник. Когда , мы говорим о мутациях, вызванных действием колхицина, мы должны понимать это определение в широком смысле значения. Колхицин не вызывает мутации гена, как например рентгеновские лучи, а только изменяет, удваивает хромосомное число клетки. Концентрации рабочего раствора колхицина, используемого для стимулирования полиплоидизации, обычно имеют 0, 01 %, 0,02 %, 0, 25 %, 0,5 %, 1 %. Применение которых, будет зависеть от вида ткани и способа обработки. Обычно начинают с применения больших доз колхицина, но они могут полностью убить семена и сеянцы, поэтому начинать эксперименты с колхицином надо на менее ценных сортах или иметь дубликат экспериментального лилейника. Длительность обработки является важным показателем и определяется для каждого типа материала индивидуально. Длительность обработки зависит от времени, необходимого для цикла деления хромосом в ядре конкретной ткани. Для обработки применяют как водный раствор колхицина разной концентрации, так и раствор колхицина в касторовом масле, глицерине, агар-агаре. Приготовление исходного раствора колхицина : Налить 10 мл дистиллированной воды в мерный цилиндр . Взвешиваем на мерных весах 100 мг ( 0,1 г ) колхицина. Аккуратно ссыпаем порошок колхицина в бутылочку добавляем воду, плотно закрываем и встряхиваем. Порошок колхицина хорошо растворяется в воде . Мы получили 1% раствор колхицина. Для получения растворов различных концентраций: 0,5 % раствор : 50 мг ( 0, 05 г ) колхицин , 10 мл воды 0,5 % раствор : 500 мг ( 0,5 г ) колхицин , 100 мл воды 0,5 % раствор: 5 мл 1% раствора , 5 мл воды 0,25 % раствор: 25 мг ( 0,025 г ) колхицин , 10 мл воды 0,25 % раствор: 250 мг ( 0, 25 г ) колхицин , 100 мл воды 0,25 % раствор: 5 мл 0,5 % раствора , 5 мл воды 0,25 % раствор: 5мл 1 % раствора , 15 мл воды Для повышения эффективности проникновения раствора колхицина в растительные ткани, можно добавить 2-5 капель чистого ДМСО , и 1/10 капли ПАВ ( поверхностно-активного вещества ) Еще один рецепт приготовления раствора колхицина , дает S. A. Zolock ( 2003 ) 1 грамм колхицина разводится в 470 мл 0,1 % раствора кинетина и добавляется 30 мл 5 % ДМСО . Кинетин - гормон роста добавляется для стимуляции клеточного деления . G. Doorakian ( 2006 ) также, использует кинетин для приготовления раствора колхицина . Исходный раствор : 500мг ( 95 % ) порошка колхицина добавляется в раствор кинетина (10 мл дистиллированной воды и 1 мг кинетина). Этот раствор может храниться в холодильнике до 6 месяцев. Рабочий раствор : взять 10 мл исходного раствора и добавить 10 капель ДМСО ( 99,7 % ) Раствор применяется для колхицинирования открытой вегетативной меристемы. 4 капли раствора капаются за один прием обработки, на открытый срез корневой шейки лилейника. Наилучшим временем для экспериментов по преобразованию лилейников считается весна - период активного роста, а также во время второй волны активного роста, через две недели после цветения. Гибридизаторы до сих пор находятся в поиске наиболее результативной методики по преобразованию диплоидных лилейников в тетраплоидные. Результаты полученные в этих исследованиях показывают, что методы, которые используют гибридизаторы лилейников в настоящее время, для преобразования диплоидной зародышевой плазмы в тетраплоидный уровень, приводят к получению преимущественно миксоплоидов. Это означает, что полученные преобразованные лилейники фактически являются химерными растениями, состоящими из диплоидных, тетраплоидных (увеличение числа хромосом в два раза) и октоплоидных (в четыре раза) тканей. Это явление может частично отразиться на более высоком уровне стерильности в потомстве гибридов, при использовании новообращенных клонов. МЕТОДЫ КОЛХИЦИНИРОВАНИЯ ЛИЛЕЙНИКОВ “Гибридизатор должен использовать достижения науки преобразования, но мастерство гибридизации – это элемент, который не поддается количественному определению .” Bill Waldrop ВНИМАНИЕ! Колхицин является высокотоксичным ядом ! Хотя сурфлан и трифлуралин является более безопасными, чем колхицин, но они также относятся к высокотоксичным ядам ! Обязательно при работе с ядами пользоваться правилами техники безопасности: использование перчаток, защитных очков, не использовать для экспериментов кухонную утварь. Не пить, не есть, не курить во время экспериментов! Если вдруг после работы с ядами вы ощутили привкус чеснока во рту, характерный для ДМСО. У вас проблемы ! Диметилсульфоксид способствует быстрому проникновению химического раствора в человеческие и растительные ткани. ЗАДУМАЙТЕСЬ ! Насколько вы были не осторожны в работе с ядами. Последствия могут быть печальными ! Хранить колхицин при t + 25 С вдали от источников тепла, влаги и света. Кратковременное хранение при температуре 15 С и 30 С не допускается. Беречь от детей и животных! Для нейтрализации и обработки места проведения опытов можно применять раствор хлорки 10 : 01, который окисляет колхицин в относительно безвредные соединения. Инструменты и материалы 1. Лабораторные очки. 2. Медицинские перчатки. 3. Аналитические весы. 4. Мерный цилиндр ( с точной мерой эквивалентной 10 мл ). 5. Микро-шпатель или мерная ложечка. 6. Дистиллированная вода. 7. Пипетки. 8. Бутылочка из темного стекла с герметической крышкой. 9. ДМСО ( 99,9% ) 10. Респираторы одноразовые. 11. Скальпель или нож для резки. 12. Шприцы медицинские ,большие и маленькие, для инъекций инсулина. 13. Микроскоп. 14. Журнал для ведения записей. Процедура обработки семян водным раствором колхицина  1. Проращиваем семена традиционным способом во влажной салфетке до появления белых корешков. 2. Процесс обработки химическими мутагенами начинать на 5-8 день, когда все семена покажут прорастание. 3. Проросшие семена положить в стеклянный контейнер, залить семена рабочим раствором колхицина или оризалина и обрабатывать 24 часа в темноте * . Не использовать пластиковую посуду и не покрывать семена марлей или салфеткой, во избежание поглощения активного вещества. Концентрация раствора может выглядеть очень слабой, не поддавайтесь искушению повысить концентрацию раствора. Температура воздуха при обработке должна быть 26С - 29С. Препарат влияет на клетки, которые активно делятся, поэтому температурный режим очень важен для успешной полиплоидизации. Температура должна быть достаточно велика, чтобы стимулировать быстрое деление клеток. 4. После 24-часовой обработки, основания растущих побегов должны быть опухшими, это работает, как идентификация того, что обработка была эффективной. 5. Завернуть семена в марлю и промывать под медленно текущей проточной водой, в течение 4 часов. 6. Семена садим в плодородную почвенную смесь не слишком глубоко, так как семена после обработки очень склонны к гниению. Можно создать тепличные условия во избежание потери влаги. Полив редкий, почва должна быть слегка влажной. 7. Проращивание сеянцев проходит в хорошо прохладных 22С – 23С, в тускло освещенных условиях, пока не начнется активный рост. После семи дней роста освещенность постепенно можно увеличивать. Смертность сеянцев может достигать до 50 %. 8. У преобразованных сеянцев листья будут жесткие, деформированные и иметь более глубокий зеленый цвет. Появление первых проростков будет иметь вид не острых перышек, а как бы маленьких зеленых комочков. Окончательный итог о преобразовании можно подвести на основании визуального анализа размеров пыльцы и устьиц листа лилейника, по сравнению с необработанными растениями. Эта процедура влияет на все части растения. Единственный недостаток, что корни обработанных растений очень плохо растут. *S. Zolock (2003) предлагает замачивать семена лилейника в 0,25% растворе на 72 часа. Инъекционный метод колхицинирования цветоноса лилейника Первый раз методика колхицинирования с применением шприца проводилась в 1948 году. С каждым годом методика совершенствовалась и к 1955 году эксперименты показали, что инъекционный способ введения колхицина в цветочный стебель, является эффективным для получения тетраплоидной пыльцы и семян. Инъекционный метод состоит из введения раствора в сосудистую систему цветоноса лилейника с помощью устройства из стеклянных трубок, которое крепится на цветоносе. Методику и описание инъекционного прибора дает Buck W.Quinn (Arcadia , California 1969). Рабочий раствор колхицина оптимальной концентрации от 0,05 % и до 0,02 % подается непрерывно по системе трубок в прокол 1 мм, в течение 24 часов. Продолжительность воздействия колхицина можно сокращать или увеличивать по мере необходимости. Сезон и температура окружающего воздуха вовремя обработки имеют важное значение. Цветонос должен быть на ранней стадии роста, когда цветочные почки достигают размера 3-5 мм для цветка диаметром 15 см. Со временем, эта техника усовершенствовалась и все также является важной в разведении тетраплоидных лилейников. Описание технологии инъекционного метода Gary Schaben . Инъекции в цветочный стебель делаются в средней зоне, чуть ниже спящей почки на 3 см. Диаметр прокола может быть 1 мм и чуть больше, для лучшего результата. Игла вводится в полость цветоноса под уклоном вверх, но так, что бы игла все время оставалась наполненной раствором колхицина, можно сказать, что игла должна быть практически вертикальна цветоносу. Очень важна стадия развития цветоноса при которой обработка колхицином будет эффективна. Цветонос должен быть в начальной фазе цветения, когда самый крупный бутон имеет размер приблизительно 2,5 – 3,5 см длинной. На этой стадии колхицин может повлиять на пыльники. Игла из стебля не вынимается, с тем, что бы после инъекции в игле оставалось немного рабочего раствора. Для процесса конверсии используется 0,025% раствор колхицина с добавлением нескольких капель ДМСО и нескольких капель синего пищевого красителя. Цель использования пищевого красителя, это визуализация поступления раствора в растительные ткани лилейника, когда чашелистики окрашиваются в синий цвет. Резервуар иглы заполняется раствором несколько раз в день . Обработка лилейника длится 1-2 суток. За несколько дней перед колхицинированием полив растений прекращается. Обработанное растение поливается после окончания процедуры, что способствует более быстрому продвижению колхицина в тканях лилейника к цветочным почкам. Инъекционная игла с рабочим раствором прикрывается защитным колпаком, для предотвращения деградации препарата от солнечных лучей. Когда колхицинированный бутон открывается, он часто имеет деформированный вид, так как представляет собой сочетание диплоидных и тетраплоидных тканей. Необходимо проверить пыльники под микроскопом, что бы убедиться в успешности конверсии. Эту методику для преобразования цветочных почек активно использовал Боб Карр (Флорида). Он также добавлял в рабочий раствор синий краситель, для визуальной индикации поглощения колхицина. За три недели до цветения обработка прекращалась. Сине-зеленый цвет пестика показывал, что колхицин достиг своей цели. Потенциально-преобразованная пыльца проверялась под микроскопом. Технология инъекционного метода Stephen Zolock Время проведения обработки, когда бутоны лилейника на цветоносе достигают размера горошин. Поршень удаляется из инсулинового шприца. Игла шприца вводится в полость цветоноса под углом 45 градусов вниз, не прокалывая насквозь ствол цветоноса. 0,25% раствор колхицина разбавляется дистиллированной водой в два раза. Вторым шприцем набирается рабочий раствор и вводится в шприц закрепленный на цветоносе. Раствор колхицина постоянно добавляется в шприц, по мере его поглощения тканями лилейника. Необходимо накрыть шприц колпаком из фольги, для предотвращения попадания солнечного света. Обработку проводить 48 часов, после чего удалить иглу из цветоноса. Таким методом можно колхицинировать листовой узел на цветоносе лилейника, стимулируя одновременно БАП 10 (3,5 мл /100 мл воды) разрастание пролиферации (воздушного отводка), который в конечном счете преобразуется в тетраплоидный. Преимущества инъекционного метода в том, что вы не рискуете потерять весь диплоидный, экспериментальный саженец. В худшем случае вы потеряете цветонос, но всегда есть возможность для преобразования других цветоносов или повторение попытки в следующем году. Надо не забывать , что применение инъекционного метода, не дает нам получение химеры, и не вызывает полиплоидию всего растения, экспериментальный лилейник так и остается диплоидным. Но, этот метод дает нам получение тетраплоидной пыльцы, и возможность запуска новых генетических характеристик в гибридизационную линию. В этом и есть весь смысл этого мероприятия. Методы колхицинирования открытой вегетативной меристемы Современная версия инъекционного метода колхицинирования открытой вегетативной меристемы, включает в себя: обрезка стебля лилейника на 5 см выше уровня корневой шейки или на 1,5 см над уровнем земли, раствор колхицина шприцем вводится в срез. Более щадящий метод, по сравнению с резкой корневой шейки лилейника. Этот метод можно применять для преобразования диплоидных спайдеров, у которых стебель в диаметре меньший, в результате чего возникают трудности с резкой корневой шейки.  Методы J. Brennan and B.King ( 2003 ) Стебель лилейника вырезается на 1 см выше корневой шейки. Инъекции делаются два дня подряд по 1 мл - 0,2 % раствором колхицина. По второй методике, делается срез чуть выше уровня корневой шейки и открытая меристемная зона покрывается ватным тампоном, пропитанным 0,4 % раствором колхицина. Обработка ведется от 24 до 48 часов. В 2004 году Hamidou, Sakhanokho проводился эксперимент по этим методикам с увеличением дозы и концентрации колхицина. Инъекции проводились по 3мл – 0,4 % раствором колхицина. В результате преобразования были получены, преимущественно миксоплоиды. Исследования проводились для оценки методов полиплоидизации лилейников и нахождения легкой конверсионной техники, которая будет эффективно производить тетраплоиды. D.Trimmer использует 0,25 % раствор колхицина 5 раз в течение трех дней. Раствор капается по пару капель на открытый меристемный срез лилейника. Методика колхицинирования Bill Waldrop Саженец лилейника подготавливается к обработке раствором колхицина. Он пересаживается в контейнер с плодородным грунтом, в котором будет находиться ближайшие 6-8 недель. Саженец садится так, что бы корневая шейка находилась немного выше уровня почвы. Это позволит комфортнее производить резку стебля лилейника для обработки колхицином. В зависимости от механического состава почвы, как минимум за 15 дней прекращается полив экспериментального растения. Именно на этот подготовительный момент Билл обращает особое внимание. Экспериментальный лилейник должен быть максимально подсушен пред обработкой колхицином. Стебель лилейника срезается на 2 см выше уровня корневой шейки. Срезу придается овальная форма, высота доводится, приблизительно до 1 см, что бы центральная часть с молодым ростком (меленькая зеленая точка в центре корневой шейки) находилась на приоритетном уровне. Резка стебля лилейника, как говорит Билл, является наибольшим искусством в науке преобразования. Если стебель срезать высоко, процесс обработки будет не эффективным, так как колхицин не может проникать глубоко в ткани растения. Если сделать срез слишком близко к корневой шейке, лилейники погибнет. Рабочий раствор приготавливается так: 400 мл дистиллированной воды смешивается с 1 г колхицина, добавляется 1 мл - 10 капель ДМСО. График обработки: классический пример, обработка проводится 3 раза в день в течение трех дней подряд. Есть мнение, что, чем ближе к корневой шейке сделан срез, то понадобится меньшее количество процедур обработки колхицином. Другие гибридизаторы предлагают обрабатывать лилейник один раз в течение трех дней. Или в первый день растение обрабатывается колхицином один раз и в следующие два дня, по два раза на день. Некоторые лилейники очень трудно поддаются процессу преобразования. Колхицин не принимается лилейником, т.е визуально вы наблюдаете, что капли раствора не поглощаются растительной тканью. Тогда срез корневой шейки лилейника обновляется и обработка повторяется. Колхицинирование таких растений проводится на протяжении пяти дней подряд, по два раза в день. Первые несколько недель после обработки являются критическими в процессе колхицинирования. Надо приложить все усилия по сохранению лилейника в этот период. Первый полив проводить не раньше 10-15 дней после обработки растения колхицином. Затем каждые 5-6- дней вода подается в малом количестве по бороздке края горшка. Не допускать попадание влаги на обработанную корневую шейку. Колхицинированный лилейник становится очень уязвимым к бактериальному гниению. Его можно сравнить с пациентом после химиотерапии, когда организм предельно слаб, а иммунитет убит химическим воздействием лекарств. Излишняя влага в результате обильного полива приведет к неминуемой гибели лилейника. Для этого необходимо строго дозировать полив и обрабатывать срез лилейника фунгицидами (фундазол, каллоидная сера). Вести каждодневный контроль за обработанным лилейником. При необходимости проводить обрезку мертвых тканей на срезе стебля, с последующей присыпкой фунгицидом. По собственному опыту Билл отмечает, что если замечено гниение центрального ростка корневой шейки лилейника, тогда спасти растение практически не удается. Если обработка лилейника колхицином прошла относительно успешно, то визуально можно наблюдать, что рост центральной зеленой почки замедляется, происходит так называемое, явление застойного роста. Молодые листочки растущие из центра лилейника имеют вид не длинных перышек, а деформированных, широких листочков. Этот процесс роста листьев колхицинированного лилейника называется - поперечной деформацией. Дальнейшая идентификация плоидности проводится на основании цитологического анализа. Метод получения полиплоидов в культуре in vitro Разработанный метод полиплоидизации лилейника путем колхицинирования в культуре ткани(экстракорпоральная полиплоидизация), позволяет получать полиплоидные линии для использования их в последующей селекционной работе (Chen, Holden 1972; Heuser 1976; Meyer 1976). Устанавливается оптимальный состав питательной среды и концентрация колхицина, для получения микроклонов лилейника с повышенной плоидностью и жизнеспособностью. Разрабатываются параметры состава питательной среды, позволяющие ускоренно размножать исходный материал, свободный от грибных и бактериальных болезней. На основе этого разработан оригинальный метод получения растений с изменённым набором хромосом и новыми морфологическими признаками. Метод культуры ткани требует больших материальных затрат и является не практичным для гибридизаторов лилейников среднего уровня. Методика получения полиплоидных форм включает в себя, введение в культуру in vitro эксплантов, микроразмножение растений, культивирование микроклонов на питательной среде с добавлением раствора колхицина различных концентраций в течение 48 часов, проведение отбора по количеству хромосом, размножение, укоренение и перевод в закрытый грунт полученных полиплоидных лилейников. Метод позволяет получать высокий процент растений с изменённым генотипом, в качестве исходных форм для селекции. Метод колхицинирования in vitro является мощным инструментом для выращивания гермаплазмы декоративных растений (Horn 2002). ХИМЕРЫ И ЦИТОЛОГИЧЕСКИЙ АНАЛИЗ В большинстве случаев, в результате конверсии диплоидной зародышевой плазмы лилейника в тетраплоидную, гибридизаторы получают преимущественно миксоплоиды. Это означает, что преобразованные лилейники являются фактически химерными растениями. "Химера" - это растение-мутант, неоднородный генетически организм, в котором существует несколько видов клеток с генетически различным строением. Примером видимой мутации хлоропластов и образования химерного растения является пестролистность или появление секторов ткани другого цвета. Лилейник – химера состоит одновременно из диплоидных, тетраплоидных и октоплоидных тканей . Это говорит о том , что преобразование было не полным. Различные клеточные типы четко разделены в пространстве, образуя отдельные слои при делении апикальных меристем.   Апикальная меристема побега - место, где находится большинство клеток, которые производят все тело растения. Клеточные деления происходят в активно растущем побеге очень быстро, и поделившиеся клетки растут в длину и ширину, обеспечивая рост побега в длину. Для лучшего понимания этого явления рассмотрим зону точки роста лилейника, так называемую зону апикальной меристемы. Она имеет три апикальных слоя клеток. 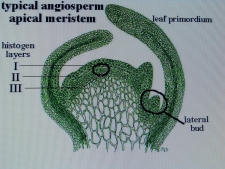 Обычный метод описания генотипов областей туники (внешней слоистой области ) и корпуса (внутренней области, где иерархия клеток не очевидна ) - использование сокращений L-I, L-II, и L-III, начиная с внешнего слоя. Каждый слой несет ответственность за производство различных частей растения. Слой L-I ответственный за формирование эпидермиса всех органов и формирует мезофильную ткань листа лилейника вдоль поля листа. Слой L-II ответственный за формирование пыльцы и семян (флоральных органов растения), за всю мезофильную ткань лепестков и чашелистиков, а так же за ткань во внешней части листа, около которой формировалась L-I. Из клеток апикального слоя L-III формируется мезофильная ткань центральной области листа , ствол и корни . Таким образом , что бы иметь полное и всестороннее преобразование лилейника, ткани всех клеток, всех трех слоев должны быть изменены с диплоидных в тетраплоидные. Если в результате обработки колхицином изменения происходят в только некоторых клетках, то в результате получаем растение, ткани которого состоят из смеси клеток различного уровня плоидности, т.е. – химера . Это явления наблюдается наиболее часто в процессе преобразования лилейников, когда получается не чистый полиплоид, а химера (Arisumi 1964) . В зависимости от того, в каком слое апикальной системы лилейника произошла полиплоидизация, получаем один их трех типов химер. Структурная классификация химер включает мериклинальные , периклинальные и секториальные химеры. Мериклинальные химеры - тип периклинальных, где мутировала только часть слоя. Измененный клеточный слой может поддерживаться только на одной стороне меристемы. В результате получается, часть цветочного стебля с одной стороны лилейника тетраплоидная. Мериклинальные химеры часто проявляются в лилейниках пестролистностью. Мериклинальные химеры обычно неустойчивы и со временем возвращаются к чистому диплоидному уровню. 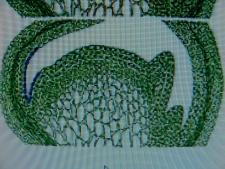 Периклинальные химеры возникают при полиплоидизации, если клетка- мутант находилась около апикального купола и так, что образующиеся от нее клетки сформировали полный слой из измененного типа. Периклинальные более устойчивы, расположение на побеге как "рука в перчатке", области туники-корпуса. Периклинальные химеры - наиболее важный тип, так как они относительно устойчивы и могут быть вегетативно размножены.  Секториальная химера - когда процесс мутаций затрагивает целый сектор апикальной меристемы, простирающийся через все клеточные слои вглубь. Этот тип химер непостоянен и не представляет никакой ценности для гибридизаторов лилейников. Секторальные химеры иногда проявляются в лепестках и чашелистиках лилейника, изменяющих цвет в результате мутации. 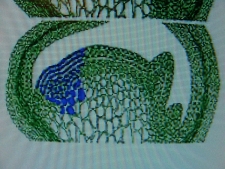 Мериклинальные и секторные химеры - по своей природе очень нестабильны и вероятность размножения растений с тем же самым фенотипом от них низка. Многие химерные растения в конце концов вернуться к диплоидному уровню или становятся не пригодными в последующей селекционной работе. Успех преобразования довольно низок, в пределах 10 % , хотя некоторые гибридизаторы успешно получают стабильные тетраплоиды. Наиболее стабильные тетраплоиды получаются , если все три клеточных слоя апикальной меристемы становятся тетраплоидными в результате конверсии . Когда мы обрабатываем растение колхицином, мы не знаем , на каком клеточном уровне произойдет полиплоидизация. Скорее всего полученное растение будет химерой, и первые цветы будут производить смесь диплоидных и тетраплоидных гамет. Такие растения требуют повторной обработки колхицином, которая зачастую приводит к получению стабильных тетраплоидов. При достаточно высоком содержании диплоидных клеток (до 50% и выше) в миксоплоидах появляется опасность их деполиплоидизации, т.е. возвращения растения на исходный диплоидный уровень. Поэтому для сохранения полиплоидной ткани необходима дополнительная работа по расхимериванию, для чего удаляют диплоидные быстрорастущие, стимулируя развитие более медленно растущих тетраплоидных тканей. Соматическая полиплоидизация может произойти в любом месте растения, но она становится важной для гибридизатора тогда, когда она проходит в апикальной меристеме стебля и поражает клетки, которые в конечном счете формируют пыльцу и яйцеклетки лилейника.  С целью подтверждения правильности выбранного метода колхицинирования проводится цитологический анализ . При использовании колхицинированных растений в разведении, является очень важным определить, какой тип химеры получен и какова плоидность слоя L-II. Идентификацию полиплоидных растений можно проводить с помощью прямых цитологических методов (прямой подсчет числа митотических или мейотических хромосом), методом проточной цитометрии (Saito 2003 ), либо с помощью косвенных методов: - морфологические (отбор возможных полиплоидов по ряду морфологических аномалий в сравнении с диплоидным контролем). Преобразованный тетраплоидный лилейник наблюдается в течение двух лет. Визуальные различия между диплоидным лилейником и его преобразованным клоном. 1. Тетраплоидная листва будет более широкая , гребенчатая, иметь темно-зеленый цвет. 2. Верхняя поверхность тет . листвы будет шероховатой. 3. Тет. Цветоносы короче и тяжелее. 4. Концы тет. Чашелистиков толще чем дип. И как правило открываются преждевременно. 5. Тет яичник может быть короче и шире в диаметре. 6. Большинство сегментов цветка имеют толстую массивную текстуру. 7. Тет пестики большего диаметра и могут иметь скрученный или надломленный вид. 8. Тет цветоносы более восприимчивы к вертикальным трещинам . 9. Цветы тетраплодных лилейников , как правило большие и имеют интенсивную окраску. 10. Изменение окраски цветков ( темные больше всего присущи тет цветку ) - цитологические (основанные на анализе изменений ультраструктуры клеток); 1). анализ размера устьичных клеток . Метод используется , если лилейник еще не цвел. Диплоидные устьичные клетки имеют длину от 27 до 36 микрон, тетраплодиные – от 36 до 51 микрон (S.Zolock 2003) 2). анализ диаметра пыльцевых зерен (Arisumi 1965). Размер пыльцевых зерен цветка лилейника не имеет ничего общего с размером самого цветка. Размер пыльцевых зерен диплоидного лилейника колеблется от 80 до 120 микрон. Размер тетраплоидной пыльцы в диапазоне от 110 до 170 микрон. (S.Zolock 2003)  ЗАКЛЮЧЕНИЕ Положительные эффекты полиплоидии связаны с увеличением числа копий одного и того же гена в клетках и соответственно, в увеличении дозы (концентрации) ферментов. Однако, несмотря на то, что много полиплоидов уже разработано, они всегда будут оказываться ниже своих диплоидных предшественников. Соматические удвоения не вводят какой либо новый генетический материал , а скорее создают дополнительные копии существующих хромосом. Это дополнительное ДНК должно быть воспроизведено с каждым делением клетки. Высокий уровень полиплоидов в химерных тканях, может привести к уродливым формам и чахлым растениям, к угнетению физиологических процессов, что возможно в результате генетической избыточности и соматической нестабильности. Необходимы дальнейшие исследования для определения простых и надежных методов преобразования Hemerocallis, которые будут эффективно производить тетраплоиды, увеличивающие генетическое разнообразие лилейников при сохранении плодородия. Несмотря на недостатки соматически индуцированных полиплоидов они могут быть полезны для использования в программах разведения для повышения степени гетерозиготности и выбора желаемых качеств. Необходимо помнить, что в преобразованной форме лилейника присутствуют не только двойная доза доминирующих генов, а и удваиваются рецессивные характеристики. Возможности полиплоидии в Hemerocallis, это преодоление барьеров на пути гибридизации, повышение устойчивости к вредителям, болезням и стрессу, восстановление плодородия отдаленных гибридов, развитие триплоидной зародышевой плазмы лилейников с применением эмбриона спасательной полиплоидизации, разработка гексаплоидных лилейников (Morejohn 1987, Levin 1983, Horn 2002). На данный момент 64329 сортов лилейников зарегистрировано Американским Обществом Hemerocallis (AHS 2009). Не смотря на увеличение числа зарегистрированных сортов с каждым годом, генетическое разнообразие сортов лилейников быстро убывает (Tomkins 2001). Эта тенденция продолжает развиваться, поскольку в настоящее время усиливается целевое развитие, преимущественно лилейников тетраплоидных сортов, на преобразование которых было задействовано ограниченное число диплоидных генотипов. Комплексный процесс полиплоидизации позволяет получать зародышевую плазму лилейников в больших масштабах, что является необходимым условием для успешного выбора генетического материала с коммерческим потенциалом. © Светлана Пикалова 2010 год Эта информация была собрана из числа источников, в том числе научные статьи, заметки, сообщения по электронной почте, опубликованные тексты и распространяется для оказания помощи селекционерам, как профессионалам, так и любителям в попытках вызвать полиплоидию у лилейника и других растений в экспериментальных и исследовательских целях. Литература American Hemerocallis Society. archives 1. Oscie B. Whatley, HYBRIDIZING WITH CONVERTED TETRAPLOIDS II , Missouri 2. Sakhanokho , Hamidou Evaluation of techniques to induce polyploidy daylilies - 2004 3. Stephen A. Zoloek "Polyploidy in Daylily and Hosta" - August 2003 4. S.K. Gulia, B.P. Singh, J. Carter, R.J. Griesbach. Daylily, Botany, Propagation, Breeding. 5. с разрешения Bill Waldrop http://billwaldropdaylilies.com/ 6. G.Doorakian http//www.patriotdaylilysociety.org/ PDS Colchicine Conversion Clinic 7. MaryAnn Pruden ,Hummelstown, PA http://www.lilyhouseonline.com/ 8. Buck, W.Q. An injection method for treating Hemerocallis spikes with colchicines . 1969. 9. Joseph C. Halinar. Polyploidy and Unreduced Gametes , The Daylily Journal, Vol 45, No. 4, 1990. 10. Zhiwu Li , Linda Pinkham , N. Faith , Campbell Development of triploid daylily (Hemerocallis) germplasm by embryo rescue. 2008-2009 11. C.H.Chen , Yvonne C. Goeden-Kallemeyn. In vitro induction of tetraploid plants from colchicines-treaded diploid daylily callus – Euphytica 1978 12. Haig Dermen, Colchicine Polyploidy And Technique, US Horticultural Station, Beltsville , MD Botanical Review, Vol. 6, No. 11 (Nov., 1940), pp. 599-635   Понедельник, 09 Декабря 2019 18:42:36 | #4
Евгений
Четверг, 26 Сентября 2019 13:54:58 | #3
Очень познавательный и полезный материал. Чудесное изложение,доходчиво и понятно. Однако, меня больше интересует применение этих методик к ирисам (высокие бородатые). Статей по полиплоидизации ирисов не нашел.Огромное спасибо Автору за чудесные статьи!
маша
Пятница, 13 Марта 2015 10:42:32 | #2
спасибо за информацию! очень много узнала нового.
Николай -дилетант
Вторник, 17 Декабря 2013, 18:50:12 | #1
Спасибо!Понятно хотя многог инфы для новичка
|

